|
เอนไซม์ไพราโนสออกซิเดส (Pyranose
Oxidase; P2O) |
เอนไซม์ไพราโนสออกซิเดส
(pyranose oxidase; P2O) จากเชื้อรา
Trametes multicolor เป็นเอนไซม์ในกลุ่ม
flavoprotein oxidase ที่มีฟลาวินไดนิวคลีโอไทล์
(FAD) เป็นโคแฟกเตอร์ (ตัวช่วยในการทำปฏิกิริยา)
โดยการเชื่อมต่อด้วย พันธะโควาเลนต์ของไนโตรเจน
ตำแหน่งที่ 3 ของกรดอะมิโนฮิสทิดีน
(His167) กับหมู่ methyl ของคาร์บอนตำแหน่งที่
8
ของ FAD ปฏิกิริยาที่เร่งด้วยเอนไซม์
P2O นี้ ถือว่าเป็นปฏิกิริยาที่มีความสำคัญในการสร้างสารจำพวกคาร์โบไฮเดรต
เนื่องจากคาร์บอนตำแหน่งที่ 2 ของน้ำตาลไพราโนสที่ถูกออกซิไดซ์
จะทำให้ได้น้ำตาลที่อยู่ในรูปของคีโตน
(2-keto sugar) เป็นสารผลิตภัณฑ์ ซึ่งสารนี้จะถูกนำไปใช้ต่อในกระบวนการ
chiral syntheses ที่เป็นประโยชน์ อาทิ
การสังเคราะห์น้ำตาล
D-tagatose ซึ่งสามารถให้ความหวานแต่ให้พลังงานน้อย
และไม่ทำให้ฟันผุ นอกจากนี้การเร่งปฏิกิริยาของเอนไซม์
P2O ยังอาจนำมาประยุกต์ใช้สำหรับเป็นตัวตรวจวัดชีวภาพ
(biosensor) เพื่อใช้สำหรับวินิจฉัยโรค
และ้ใ้ช้ในด้านการพัฒนาทาง อุตสาหกรรมอาหารและเครื่องดื่ม
ซึ่งปฏิกิริยาที่เร่งด้วยเอนไซม์นั้นค่อนข้างถูก
เนื่องจากใช้ก๊าซออกซิเจนเป็นออกซิเดนท์
และ ใช้สภาวะในการทำปฏิกิริยาที่ไม่รุนแรง
รวมทั้งยังเป็นมิตรกับสิ่งแวดล้อมอีกด้วย
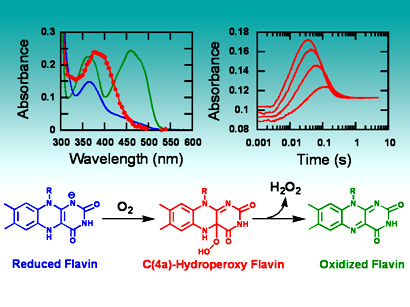
การศึกษาจลนพลศาสตร์ของเอนไซม์ไพราโนสออกซิเดสโดยกลุ่มวิจัยของเรา
ได้พบว่าในกลไกการเร่งปฏิกิริยานั้น
มีสารตัวกลาง (intermediate) เป็น C(4a)-hydroperoxyflavin
ซึ่งการค้นพบนี้ เป็นการตรวจพบครั้งแรกว่า
เอนไซม์ในกลุ่ม ออกซิเดสใช้สารดังกล่าวเป็นสารตัวกลางของปฎิกิริยา
(Suchanitakul et al., 2008) ดังนั้นงานวิจัยในปัจจุบัน
เป็นการศึกษา เพื่อที่จะทำความเข้าใจในโครงสร้างสามมิติและการทำงานของเอนไซม์
P2O ว่าเหตุใดจึงเกิดสารตัวกลาง C(4a)-hydroperoxyflavin
ที่เสถียรกว่าเอนไซม์อื่นๆในกลุ่มเดียวกัน
นอกจากนี้เราพบว่า P2O ยังสามารถใช้
2-fluoro-D-glucose และ 2-deoxy-D-glucose
เป็นสารตั้งต้นในการเร่งปฏิกิริยา จากผลการศึกษาดังกล่าวทำให้เราทราบว่า
P2O สามารถเร่ง ปฏิกิริยาออกซิเดชั่นของน้ำตาลในกลุ่มไพราโนส
ที่คาร์บอนตำแหน่งที่ 2 และ 3 ได้อีกด้วย
(Kujawa et al., 2006)
เป้าหมายของงานวิจัย
1. เพื่อศึกษากลไกการเกิดปฏิกิริยาของเอนไซม์ไพราโนสออกซิเดส
ที่มีการเปลี่ยนแปลงหมู่กรดอะมิโนที่อยู่บริเวณ
เร่งปฏิกิริยาไปเป็นกรดอะมิโนต่างชนิด
(site-directed mutagenesis)
2. เพื่อศึกษาปัจจัยสำคัญที่ทำให้เอนไซม์ไพราโนสออกซิเดส
เกิดสารตัวกลาง C(4a)-hydroperoxyflavin
ที่เสถียรกว่า เอนไซม์อื่นๆในกลุ่ม
flavoprotein oxidase
ติดต่อเรา:
ห้องปฏิบัติการ (LAB) PR305 ตึก PR
ชั้น 3
ภาควิชาชีวเคมี
คณะวิทยาศาสตร์ มหาวิทยาลัยมหิดล
ถนนพระรามที่ 6 กรุงเทพฯ 10400
โทร. 02-201-5596
หน่วยวิจัยโครงสร้างและการทำงานของโปรตีน
(CPSF)
อาคารเฉลิมพระเกียรติ ชั้น 4 ห้อง K419
คณะวิทยาศาสตร์ มหาวิทยาลัยมหิดล
272 ถนนพระรามที่ 6 กรุงเทพฯ 10400
โทร: 02-201-5847 โทรสาร : 02-201-5843
e-mail : pimchai.cha@mahidol.ac.th
|